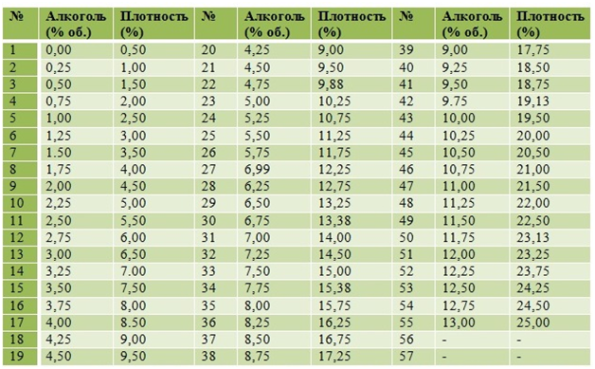
Формула оксидов
Содержание:
- Получение
- Номенклатура комплексных солей*
- Качественные реакции органических веществ
- Взаимодействие кислорода с простыми веществами
- Спирты и фенолы
- Химические свойства
- Правила составления названий алканов
- Тривиальная номенклатура
- Перекись водорода в природе
- Тренировочные задания
- Где применяется Н2О2 сейчас?
- Альдегиды и кетоны
- Происхождение названия
- Физические свойства
Получение
Перегонка жидкого воздуха
В настоящее время в промышленности кислород получают из воздуха.
Основным промышленным способом получения кислорода является криогенная ректификация.
Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
- 2KMnO4→tK2MnO4+MnO2+O2↑{\displaystyle {\ce {2KMnO4 -> K2MnO4 + MnO2 + O2 ^}}}
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца(IV):
- 2H2O2→MnO22H2O+O2↑{\displaystyle {\ce {2H2O2 -> 2H2O + O2 ^}}}
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
- 2KClO3⟶2KCl+3O2↑{\displaystyle {\ce {2KClO3 -> 2KCl + 3O2 ^}}}
Разложение оксида ртути(II) (при t = 100 °C) было первым методом синтеза кислорода:
- 2HgO→100°C2Hg+O2↑{\displaystyle {\ce {2HgO -> 2Hg + O2 ^}}}
Электролиз водных растворов
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
- 2H2O→e−2H2↑+O2↑{\displaystyle {\ce {2H2O -> 2H2 ^ + O2 ^}}}
Реакция перекисных соединений с углекислым газом
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
- 2Na2O2+2CO2⟶2Na2CO3+O2↑{\displaystyle {\ce {2Na2O2 + 2CO2 -> 2Na2CO3 + O2 ^}}}
Для соблюдения баланса объёмов поглощённого углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.
Номенклатура комплексных солей*
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Комплексные соединения состоят из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом. Как правило (но не обязательно!), число лигандов в 2 раза больше, чем степень окисления центральной частицы.

Соединения с комплексными катионами. Вначале называют анион внешней сферы, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
Например:
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные.
Например:
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Например:
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
* материалы с портала onx.distant.ru
Качественные реакции органических веществ
|
Вещество, функциональная группа |
Реактив |
Схема реакции |
Характерные признаки |
|
Непредельные углеводороды (алкены, алкины, диены), кратные связи |
р-р KMnO4 (розовый) |
СН2=СН2 + Н2О + КMnO4 → КОН + MnO2↓+ СН2(ОН)-СН2(ОН) |
обесцвечивание р-ра |
|
р-р I2 (бурый) |
СН2=СН-CН3 + I2 → СН2(I)-СН(I)-CH3 |
обесцвечивание р-ра |
|
|
р-р Br2 (желтый) |
СН2=СН2 + Br2 → СН2(Br)-СН2(Br) |
обесцвечивание р-ра |
|
|
Ацетилен |
аммиачный р-р Ag2O |
образование осадка (ацетиленид серебра) белого цвета (взрывоопасен) |
|
|
Бензол |
нитрующая смесь HNO3 + H2SO4 |
tC, H2SO4(конц.) C6Н6 + HNO3 → C6H5-NO2 + H2O |
образование тяжелой жидкости светло-желтого цвета с запахом горького миндаля |
|
Толуол |
р-р KMnO4 (розовый) |
C6Н5-СН3 + KMnO4 + H2SO4 → C6Н5-COOH + H2O + K2SO4 + MnSO4 |
обесцвечивание р-ра |
|
Фенол (карболовая кислота) |
р-р FeCl3 (светло-желтый) |
C6Н5OH + FeCl3 → (C6Н5O)3Fe + HCl |
окрашивание р-ра в фиолетовый цвет |
|
насыщенный р-р Br2(бромная вода) |
C6Н5OH + 2Br2 → C6Н2Br3OH↓ + HBr |
образование белого осадка со специфическим запахом |
|
|
Анилин (аминобензол) |
р-р хлорной извести CaOCl2 (бесцветный) |
окрашивание р-ра в фиолетовый цвет |
|
|
Этанол |
насыщенный р-р I2 + р-р NaOH |
C2H5OH + I2 + NaOH → CHI3↓ + HCOONa + NaI + H2O |
образование мелкокристаллического осадка СНI3 светло-желтого цвета со специфическим запахом |
|
CuO (прокаленная медная проволока) |
C2H5OH + CuO → Cu↓ + CH3-CHO + H2O |
выделение металлической меди, специфический запах ацетальдегида |
|
|
Гидроксогруппа (спирты, фенол, гидроксикислоты) |
Металлический Na |
выделение пузырьков газа (Н2), образование бесцветной студенистой массы |
|
|
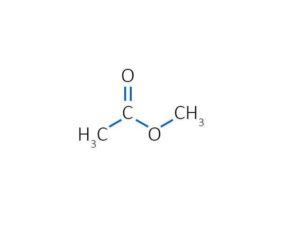
Эфиры (простые и сложные) |
Н2О (гидролиз) в присутствии NaOH при нагревании |
CH3-C(O)-O-C2H5 + H2O CH3COOH + C2H5OH |
специфический запах |
|
Многоатомные спирты, глюкоза |
Свежеосажденный гидроксид меди (II) в сильно щелочной среде |
ярко-синее окрашивание р-ра |
|
|
Карбонильная группа – СНО (альдегиды, глюкоза) |
Аммиачный р-р Ag2O |
образование блестящего налета Ag («серебряное зеркало») на стенках сосудов |
|
|
Свежеосажденный Сu(OH)2 |
R-CHO + Cu(OH)2 → R-COOH + Cu2O↓ + H2O |
образование красного осадка Сu2O |
|
|
Карбоновые кислоты |
лакмус |
окрашивание р-ра в розовый цвет |
|
|
р-р Na2CO3 |
выделение СО2 |
||
|
спирт +H2SO4(конц.) |
R-COOH + HO-R1 RC(O)OR1 + H2O |
специфический запах образующегося сложного эфира |
|
|
Муравьиная кислота |
Свежеосажденный Сu(OH)2 |
образование красного осадка Сu2O |
|
|
Аммиачный р-р Ag2O |
«серебряное зеркало» на стенках сосуда |
||
|
Олеиновая кислота |
р-р KMnO4 (розовый) или I2 (бурый) или Br2(желтый) |
C17H33COOH + KMnO4 + H2O → C8H17-CH(OH)-CH(OH)-(CH2)7-COOH + MnO2↓ + KOH C17H33COOH + I2 → C8H17-CH(I)-CH(I)-(CH2)7-COOH |
обесцвечивание р-ра |
|
Ацетаты (соли уксусной кислоты) |
р-р FeCl3 |
CH3COONa + FeCl3 → (CH3COO)3Fe + NaCl |
окрашивание р-ра в красно-бурый цвет |
|
Стеарат натрия (мыло) |
Н2О (гидролиз) + фенолфталеин |
C17H35COONa + H2O C17H35OOH↓ + NaOH |
окрашивание р-ра в малиновый цвет |
|
насыщенный р-р соли кальция |
C17H35COONa + Ca2+ (C17H35COO)2Ca↓ + Na+ |
образование серого осадка |
|
|
Концентрированная неорганическая кислота |
C17H35COONa + H+ C17H355COOH↓ + Na+ |
образование белого осадка |
|
|
Белок |
пламя |
реакция горения |
запах «паленого», жженых перьев |
|
НNO3 (конц.);t, °С |
ксантопротеиновая реакция (происходит нитрование бензольных колец в молекуле белка) |
|
|
|
Свежеосажденный Сu(OH)2 |
биуретовая реакция (образуется комплексное соединение) |
сине-фиолетовое окрашивание р-ра |
Взаимодействие кислорода с простыми веществами
Кислороду присуща высокая химическая активность. Многие вещества реагируют с кислородом при комнатной температуре. Так, например, свежий срез яблока довольно быстро приобретает бурую окраску, это происходит вследствие химических реакций между органическими веществами, содержащимися в яблоке, и кислородом, содержащимся в воздухе. С простыми веществами кислород, как правило, реагирует при нагревании. В металлическую ложечку для сжигания веществ поместим уголек, нагреем его в пламени спиртовки докрасна и опустим в сосуд с кислородом. Наблюдаем яркое горение уголька в кислороде. Уголь – простое вещество, образованное элементом углеродом. В реакции кислорода с углеродом образуется углекислый газ:
Стоит отметить, что многие химические вещества имеют тривиальные названия. Углекислый газ – это тривиальное название вещества. Тривиальные названия веществ используются в повседневной жизни, многие из них имеют давнее происхождение. Например, пищевая сода, бертолетова соль. Однако у каждого химического вещества есть и систематическое химическое название, составление которого регламентируется международными правилами – систематической химической номенклатурой.
Так, углекислый газ имеет систематическое название оксид углерода (IV).
Углекислый газ является сложным веществом, бинарным соединением, в состав которого входит кислород. Поместим в ложечку для сжигания веществ серу и нагреем. Сера плавится, затем загорается. На воздухе сера горит бледным, почти незаметным, синим пламенем. Внесем серу в сосуд с кислородом – сера горит ярким синим пламенем. В реакции серы с кислородом образуется сернистый газ:
Сернистый газ, как и углекислый газ, относится к группе оксидов. Это оксид серы (IV) – бесцветный газ с резким едким запахом. Теперь внесем в сосуд с кислородом подожженный красный фосфор. Фосфор горит ярким, ослепительным пламенем. Сосуд заполняется белым дымом. Белый дым – это продукт реакции, мелкие твердые частицы оксида фосфора (V):
В кислороде способны гореть не только неметаллы. Металлы также энергично взаимодействуют с кислородом. Например, магний горит в кислороде и на воздухе ослепительным белым пламенем. Продукт реакции – оксид магния:
Попробуем сжечь в кислороде железо. Раскалим в пламени спиртовки стальную проволоку и быстро опустим в сосуд с кислородом. Железо горит в кислороде с образованием множества искр. Вещество, полученное в результате реакции, называют железной окалиной:
Снопы искр, образующихся при горении бенгальского огня, объясняются сгоранием порошка железа, входящего в состав этих пиротехнических изделий. После рассмотренных реакций можно сделать важные выводы: кислород реагирует как с металлами, так и неметаллами; часто эти реакции сопровождаются горением веществ. Продуктами реакций кислорода с простыми веществами являются оксиды
Обратите внимание, что при взаимодействии кислорода с простыми веществами – металлами и неметаллами образуются сложные вещества – оксиды. Такой тип химических реакций называют реакциями соединения
Реакция соединения – реакция, в результате которой из двух или нескольких менее сложных по строению веществ, образуются более сложные по строению вещества
Спирты и фенолы
Спирты – производные углеводородов, один или несколько атомов водорода в которых заменены на гидроксильную группу -OH. Спирты с одной гидроксильной группой называют одноатомными, с двумя – двухатомными, с тремя трехатомными и т.д. Например:
Спирты с двумя и более гидроксильными группами называют также многоатомными спиртами. Общая формула предельных одноатомных спиртов CnH2n+1OH или CnH2n+2O. Общая формула предельных многоатомных спиртов CnH2n+2Ox , где x – атомность спирта.
Спирты могут быть и ароматическими. Например:
бензиловый спирт
Общая формула таких одноатомных ароматических спиртов CnH2n-6O.
Однако, следует четко понимать, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один или несколько атомов водорода при ароматическом ядре не относятся к спиртам. Их относят к классу фенолы. Например, это данное соединение является спиртом:
А это представляет собой фенол:
Причина, по которой фенолы не относят к спиртам, кроется в их специфических химических свойствах, сильно отличающих их от спиртов. Как легко заметить, однотомные фенолы изомерны одноатомным ароматическим спиртам, т.е. тоже имеют общую молекулярную формулу CnH2n-6O.
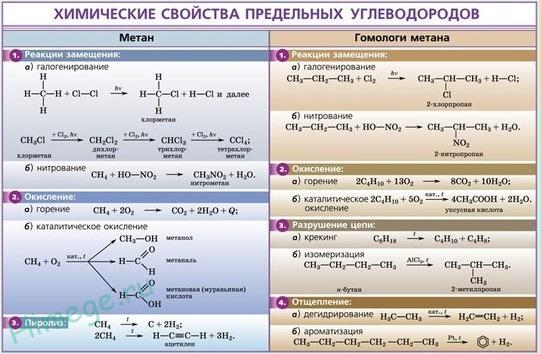
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона. Наиболее распространённая степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
- 4Li+O2⟶2Li2O{\displaystyle {\ce {4Li + O2 -> 2Li2O}}}
- 2Sr+O2⟶2SrO{\displaystyle {\ce {2Sr + O2 -> 2SrO}}}
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO+O2⟶2NO2↑{\displaystyle {\ce {2NO + O2 -> 2NO2 ^}}}
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6+15O2⟶12CO2+6H2O{\displaystyle {\ce {2C6H6 + 15O2 -> 12CO2 + 6H2O}}}
- CH3CH2OH+3O2⟶2CO2+3H2O{\displaystyle {\ce {CH3CH2OH + 3O2 -> 2CO2 + 3H2O}}}
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH+O2⟶CH3COOH+H2O{\displaystyle {\ce {CH3CH2OH + O2 -> CH3COOH + H2O}}}
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже ).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
-
- 2Na+O2⟶Na2O2{\displaystyle {\ce {2Na + O2 -> Na2O2}}}
Некоторые оксиды поглощают кислород:
-
- 2BaO+O2⟶2BaO2{\displaystyle {\ce {2BaO + O2 -> 2BaO2}}}
По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
-
- H2+O2⟶H2O2{\displaystyle {\ce {H2 + O2 -> H2O2}}}
В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
-
- Na2O2+O2⟶2NaO2{\displaystyle {\ce {Na2O2 + O2 -> 2NaO2}}}
Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
-
- K+O2⟶KO2{\displaystyle {\ce {K + O2 -> KO2}}}
Неорганические озониды содержат ион O−3 со степенью окисления кислорода, формально равной −⅓. Получают действием озона на гидроксиды щелочных металлов:
-
- 3KOH+3O3⟶2KO3+KOH⋅H2O+2O2↑{\displaystyle {\ce {3KOH + 3O3 -> 2KO3 + KOH * H2O + 2O2 ^}}}
В ионе диоксигенила O+2 кислород имеет формально степень окисления +½. Получают по реакции:
-
- PtF6+O2⟶O2PtF6{\displaystyle {\ce {PtF6 + O2 -> O2PtF6}}}
В этой реакции кислород проявляет восстановительные свойства.
Фториды кислорода
Дифторид кислорода, OF2, степень окисления кислорода +2, получают пропусканием фтора через разбавленный раствор щёлочи:
-
- 2F2+2NaOH⟶2NaF+H2O+OF2↑{\displaystyle {\ce {2F2 + 2NaOH -> 2NaF + H2O + OF2 ^}}}
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
-
- F2+O2⟶O2F2{\displaystyle {\ce {F2 + O2 -> O2F2}}}
Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, O4F2, O5F2 и O6F2.
Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония (англ.) OF+3. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3.
Правила составления названий алканов
1. Выбирают главную углеродную цепь
Главная цепь — это самая длинная и самая разветвленная непрерывная последовательность углеродных атомов
При этом неважно, как нарисованы на схеме углеродные атомы (вверх, вниз, влево, вправо). При этом углеводородные радикалы, которые не входят в главную цепь, являются в ней заместителями
Главная цепь должна быть самой длинной.
| Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а |

2. Главная цепь должна быть самой разветвленной.
| Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от главной цепи на рисунке б – один: |

3. Нумеруют атомы углерода в главной цепи.
Нумерацию следует начинать с более близкого к старшей группе конца цепи.
При наличии двух и более заместителей цепь стараются пронумеровать так, чтобы заместителям принадлежали минимальные номера.
| Например, правильная нумерация в главной углеродной цепи |
Тривиальная номенклатура
Тривиальная номенклатура сложилась исторически по мере зарождения и развития исторической химии, до появления единой системы наименования органических веществ.
Многие тривиальные названия используются и сейчас. В таблице ниже приведены тривиальные названия основных органических веществ, а также их названия по систематической номенклатуре.
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
|
Углеводороды и галогенпроизводные |
||
| Изобутан | 2-метилпропан | CH3-CH(CH3)-CH3 |
| Этилен | Этен | |
| Пропилен | Пропен | CH2=CH-CH3 |
| Дивинил | Бутадиен-1,3 | CH2=CH-CH=CH2 |
| Изопрен | 2-Метилбутадиен-1,3 | CH2=C(СH3)-CH=CH2 |
| Винилацетилен | Бутен-1-ин-3 | CH≡C-CH=CH2 |
| Толуол | Метилбензол | |
| Кумол | Изопропилбензол | |
|
орто-Ксилол,
мета-ксилол, пара-ксилол |
1,2-Диметилбензол,
1,3-Диметилбензол, 1,4-Диметилбензол |
|
| Стирол | Винилбензол | |
| Хлороформ | Трихлорметан | СHCl3 |
| Хлоропрен | 2-хлорбутадиен-1,3 | CH2=C(Cl)-CH=CH2 |
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
|
Кислородсодержащие и азотсодержащие вещества |
||
| Бензиловый спирт | Фенилметанол | |
| Этиленгликоль | Этандиол-1,2 | CH2OH-CH2OH |
| Глицерин | Пропантриол-1,2,3 | CH2OH-CHOH-CH2OH |
|
орто-Крезол,
мета-крезол, пара-крезол |
2-Метилфенол,
3-метилфенол, 4-метилфенол |
|
| Формальдегид | Метаналь | CH2=O |
| Ацетальдегид | Этаналь | CH3-CH=O |
| Анилин | Фениламин |
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
|
Карбоновые кислоты |
||
| Муравьиная кислота | Метановая кислота | HCOOH |
| Уксусная кислота | Этановая кислота | CH3COOH |
| Пропионовая кислота | Пропановая кислота | CH3CH2COOH |
| Масляная кислота | Бутановая кислота | CH3CH2CH2COOH |
| Щавелевая кислота | Этандиовая кислота | HOOC-COOH |
| Бензойная кислота | Фенилмуравьиная кислота | C6H5COOH |
Перекись водорода в природе
Не стоит считать пероксид водорода искусственным соединением, получаемым только в лабораториях. В Н2О2 содержится в дожде и снеге, в горном воздухе. В горах можно встретить источники и реки с белой от мельчайших кислородных пузырьков водой, которая справедливо считается полезной. Мало кто знает, что цвет и пузырьки обусловлены наличием в воде Н2О2, образующейся из-за хорошей её аэрации. Между тем, не стоит бояться пить такую воду некипяченой, если, разумеется, поблизости нет заводов и фабрик. Перекись водорода, естественным путем образующаяся в воде, служит обеззараживающим средством против микроорганизмов и паразитов.
Даже в результате активного встряхивания бутылки с водой в ней образуется некоторое количество пероксида, так как вода при этом действии насыщается кислородом.
В свежих фруктах и овощах Н2О2 также содержится, пока они не подвергнутся термической обработке. При нагреве, варке, обжарке и других процессах с сопутствующей высокой температурой уничтожается большое количество кислорода. Именно поэтому прошедшие кулинарную обработку продукты считаются не такими полезными, хотя какое-то количество витаминов в них остается. Свежевыжатые соки или кислородные коктейли, подаваемые в санаториях, полезны по той же причине – из-за насыщения кислородом, который дает организму новые силы и очищает его.
Тренировочные задания
1. Кислотой и амфотерным гидроксидом соответственно являются
1) H2SO4 и Zn(OH)2 2) Ca(OH)2 и HCl 3) HF и Cr2O3 4) Al(OH)3 и HNO3
2. Основанием и кислотным оксидом соответственно являются
1) Al(OH)3 и Cr2O3 2) H2SO4 и N2O 3) NaOH и Al2O3 4) Sr(OH)2 и N2O3
3. Кислой солью и несолеобразующим оксидом соответственно являются
1) NaHSO4 и N2O 2) Ba(HCO3)2 и FeO 3) NaHS и Cr2O3 4) AlCl3 и NO
4. Гидроксидом и щёлочью соответственно являются
1) H3PO4 и KOH 2) Ba(OH)2 и HBr 3) Fe(OH)3 и Fe(OH)2 4) Al(OH)3 и Ca(OH)2
5. Вещество, химическая формула которого Cr2(SO4)3, имеет название
1) сульфат хрома (III) 2) сульфит хрома (III) 3) сульфат хрома (II) 4) сульфит хрома (II)
6. Вещество, химическая формула которого CaHPO4, называется
1) фосфат кальция 2) гидрофосфат кальция 3) дигидрофосфат кальция 4) фосфид кальция
7. К простым веществам относится
1) поваренная соль 2) кислород 3) оксид кремния 4) пищевая сода
8. К простым веществам относится
1) поташ 2) углекислый газ 3) веселящий газ 4) бром
9. К сложным веществам относится
1) поташ 2) сера 3) озон 4) бром
10. К сложным веществам относится
1) фтор 2) фосфор 3) углекислый газ 4) бром
11. Только основные оксиды приведены в списке
1) Li2O, MgO, Ag2O 2) N2O, MgO, CuO 3) Cr2O3, MgO, Na2O 4) FeO, MgO, ZnO
12. Только несолеобразующие оксиды приведены в списке
1) CrO, CO, K2O 2) N2O, NO, CO 3) CrO3, SO2, Li2O 4) N2O3, MgO, P2O3
13. В перечне веществ, формулы которых: А) H2O В) HNO3 Д) CaO Б) N2O Г) H2SO4 Е) NaOH к оксидам относятся
1) АБВ 2) АБД 3) БВД 4) БДЕ
14. В перечне веществ, формулы которых: А) CaO В) Cr2O3 Д) SrO Б) Fe2O3 Г) NO Е) Li2O к основным оксидам относятся
1) АБВ 2) АБД 3) БВД 4) АДЕ
15. В перечне веществ, формулы которых: А) CO2 В) SO2 Д) SrO Б) CrO3 Г) Cr2O3 Е) CrO к кислотным оксидам относятся
1) АБВ 2) АБД 3) БВД 4) АДЕ
16. В перечне веществ, формулы которых: А) CrO В) ZnO Д) Al2O3 Б) CrO3 Г) Cr2O3 Е) NO к амфотерным оксидам относятся
1) АБВ 2) АВД 3) ВГД 4) АДЕ
17. В перечне веществ, формулы которых: А) NH4Cl В) (NH4)2HPO4 Д) Ca3(PO4)2 Б) NH4NO3 Г) NH4HSO4 Е) Ca(HCO3)2 к средним солям относятся
1) АБВ 2) БВГ 3) БВД 4) АБД
18. В перечне веществ, формулы которых: А) HCl В) (NH4)2HPO4 Д) H3PO4 Б) HNO3 Г) NH4HSO4 Е) Ca(HCO3)2 к кислотам относятся
1) АБВ 2) БВГ 3) БВД 4) АБД
19. Только сильные кислоты приведены в списке
1) HI, HClO3, HNO3 2) H2S, HI, HClO4 3) CH3COOH, H2CO3, H2S 4) HCl, HF, HBr
20. Только слабые кислоты приведены в списке
1) HI, HClO3, HNO2 2) H2SO3, HNO2, H3PO4 3) CH3COOH, H2CO3, H2SiO3 4) HCl, HF, HBr
Где применяется Н2О2 сейчас?
- в медицине — для обработки ран;
- в целлюлозно-бумажной промышленности используются отбеливающие свойства вещества;
- в текстильной промышленности перекисью отбеливают натуральные и синтетические ткани, меха, шерсть;
- как ракетное топливо или его окислитель;
- в химии — для получения кислорода, как пенообразователь для производства пористых материалов, как катализатор или гидрирующий агент;
- для производства дезинфицирующих или чистящих средств, отбеливателей;
- для обесцвечивания волос (это устаревший метод, так как волосы сильно повреждаются пероксидом);

- некоторые используют перекись для отбеливания зубов, но при этом разрушается их эмаль;
- в аквариумистике и рыбных хозяйствах используют трёхпроцентный раствор Н2О2 для оживления задохнувшихся рыб, для уничтожения водорослей и паразитов в аквариуме, а также для борьбы с некоторыми заболеваниями рыбы;
- во всех отраслях пероксид может применяться как средство дезинфекции поверхностей, оборудования, упаковки;
- для чистки бассейнов;
- для добычи металлов и нефти в горно- и нефтедобывающей промышленности;
- для обработки металлов и сплавов в металлообработке.
Альдегиды и кетоны
Альдегидами называют производные углеводородов, у которых при первичном атоме углерода два атома водорода заменены на один атом кислорода, т.е. производные углеводородов в структуре которых имеется альдегидная группа –СН=О. Общую формулу альдегидов можно записать как R-CH=O. Например:
| этаналь | метаналь |
Кетонами называют производные углеводородов, у которых при вторичном атоме углерода два атома водорода заменены на атом кислорода, т.е. соединения, в структуре которых есть карбонильная группа –C(O)-.
Общая формула кетонов может быть записана как R-C(O)-R’. При этом радикалы R, R’ могут быть как одинаковыми, так и разными.
Например:
| пропанон | бутанон |
Как можно заметить, альдегиды и кетоны весьма схожи по строению, однако их все-таки их различают как классы, поскольку они имеют существенные различия в химических свойствах.
Общая молекулярная формула предельных кетонов и альдегидов одинакова и имеет вид CnH2nO
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Физические свойства
В мировом океане концентрация растворённого O2 больше в холодных водах, меньше — в тёплых
Жидкий кислород
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его при нормальных условиях имеет массу 1,429 г., то есть немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при +50 °C) и спирте (2,78 мл/100 г при +25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при +961 °C). Хорошо растворяется в перфторированных углеводородах (20—40 об %).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы, концентрация диссоциированных атомов в смеси при +2000 °C — 0,03 %, при +2600 °C — 1 %, +4000 °C — 59 %, +6000 °C — 99,5 %.
Жидкий кислород кипит под давлением 101,325 кПа при температуре −182,98 °C и представляет собой бледно-голубую жидкость.
Фазовая диаграмма O2
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы.
Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°.
- β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
- γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å.
Ещё три фазы существуют при высоких давлениях:
- δ-O2 — интервал температур 20—240 K и давление 6—8 ГПа, оранжевые кристаллы;
- ε-фаза, содержит молекулы O4 или O8, существует при давлении от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
- ζ-On — давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.